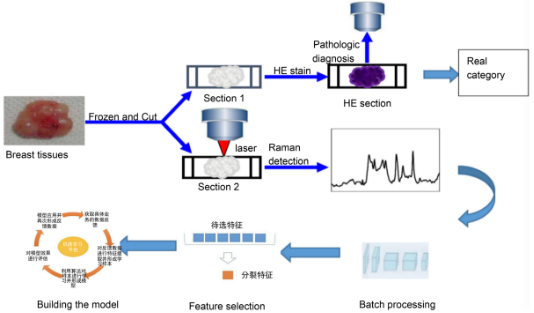
方案推介:拉曼光谱仪在乳腺癌诊断中的应用前景
一)拉曼光谱仪在乳腺癌诊断中的应用价值
乳腺癌是我国最为常见的女性癌症,其早期诊断对于患者的治疗十分重要。目前对于乳腺检查(包括: 查体、彩超、钼靶和磁共振成像等)所发现的异常(肿物、钙化灶等), 只能通过手术活检明确病变性质,但是总体活检后约70%~90% 的患者被证实为良性病变。由于病理诊断必须进行手术获取病变组织,结果受到取材组织的影响,缺乏全面性。 乳腺癌早期病灶(如导管原位癌)的组织形态学改变不明显,传统影像(超声、钼靶)易漏诊。拉曼光谱作为一种重要的光谱学方法,越来越多地应用于癌症肿物的良恶性鉴别。在波长为 600~2000 cm−1的扫描范围,拉曼光谱的每一个激发波长点上都会有不同的光谱强度。由于组织化学成分的不同,当给定相同的激发波长时,特征峰和强度表示出多样性。拉曼光谱可通过以下方式辅助早期发现:
检测乳腺组织中生化成分的微小异常:例如,恶性细胞增殖会导致核酸含量升高、蛋白质二级结构改变(如 α- 螺旋减少),这些变化会在拉曼光谱上呈现特征峰偏移(如核酸相关峰 1094 cm⁻¹ 强度增加); 可结合光纤探头实现微创 / 无创检测:无需获取完整组织标本,仅通过体表或乳腺导管内的光纤采集光谱,降低早期筛查的创伤性。
临床中,部分乳腺结节(如不典型增生)的病理诊断存在 “灰色地带",拉曼光谱可提供客观的分子层面依据,如表一所示:
通过对比光谱特征差异区分良恶性:例如,恶性组织的脂质峰(如 1440 cm⁻¹、2850 cm⁻¹)强度通常降低(因癌细胞过度消耗脂质),而良恶性组织的光谱 “指纹" 差异可通过算法(如机器学习)量化,辅助病理医生减少误诊 / 漏诊。
良性组织(拉曼特征峰cm-1) | 良性组织(拉曼特征峰cm-1) | 化学组成 |
873 | 873 | C-C stretch hypro |
1078,1298,1435,1650,1741 | 1078,1298,1435,1650,1745 | Lipids |
1175 | 1175 | Phosphodiester |
1261,1315,1638 | 1261,1315,1638 | Amide III (α-helix and β-structure)of proteins |
1340,1480 | Nucleic acids | |
1362,1383,1461 | 1364,1383,1461 | CH2 and CH3 symmetric deformation of proteins |
1534 | 1534 | Beta carotene |
1558 | 1558 | Tryptophan |
1675 | Amide I (collagen) |
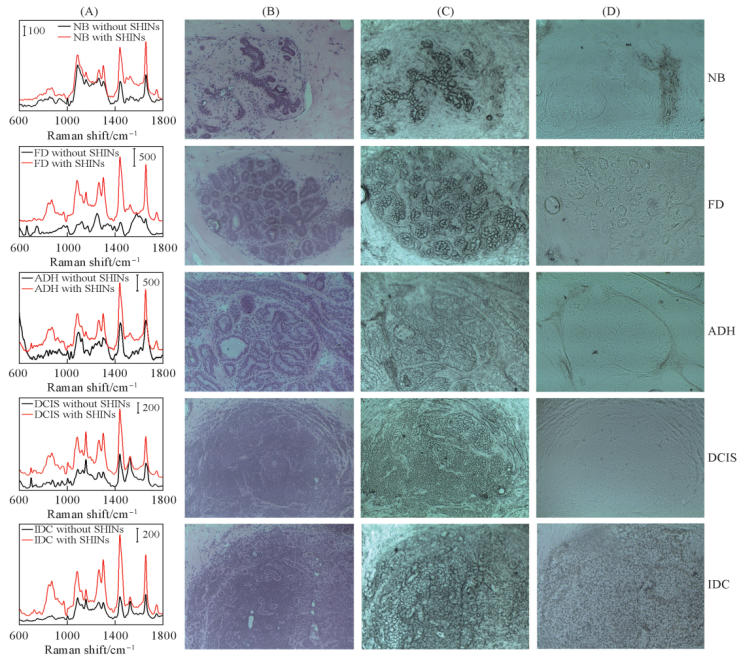
通过比较5种乳腺组织光谱(图二): 正常组织(NB)和4种病变组织(纤维腺瘤FD/癌前病变组织ADH/原位导管癌DCIS/ 浸润性导管癌,IDC),并进行区分,利用 DNA 和 β-胡萝卜素的特征峰可以将癌组织包括原位导管癌和浸润性导管癌与其它乳腺组织区分。
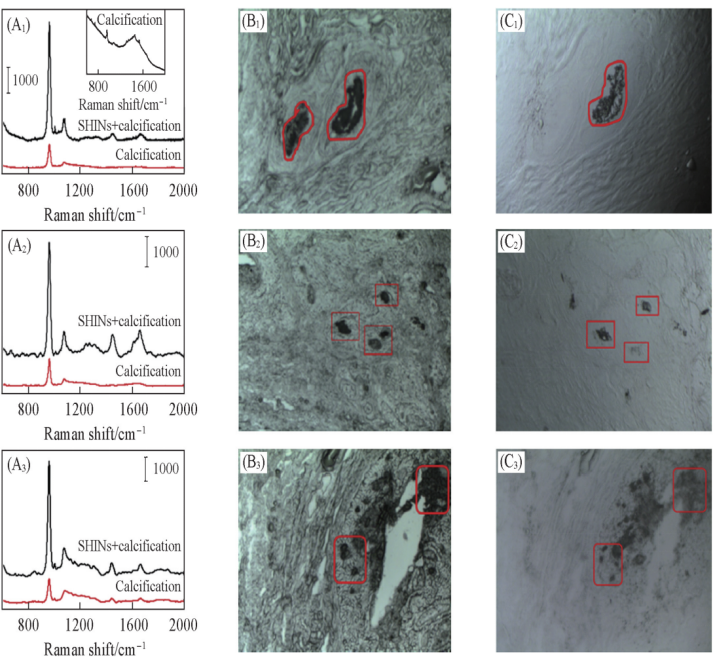
钙化作为乳腺癌诊断的一个重要指标经常出现在乳腺的早期病变组织中,利用拉曼光谱分析纤维腺瘤、癌前病变和原位导管癌组织里中域型钙化部位,从含有钙化的良性和癌前病变的乳腺组织中获得拉曼光谱(图三),利用主成分分析可以较好地对域型钙化进行鉴别。
此外,在乳腺癌手术中,医生需快速判断切除边缘是否残留癌细胞,传统冰冻切片需 30 分钟以上,且存在取样误差,拉曼光谱可实现实时指导肿瘤精准切除:
实时原位检测
:通过手持探头直接接触手术切缘组织,1-2 分钟内获取光谱并判断是否存在癌细胞; 提高切缘阴性率
:帮助医生精准界定肿瘤边界,减少因切缘阳性导致的二次手术,同时避免过度切除正常乳腺组织(保护患者外观与功能)。
综上,拉曼光谱仪为乳腺癌诊断提供了 “分子层面" 的新工具,尤其在早期筛查、精准鉴别及术中指导中潜力显著,未来有望成为传统诊断技术(影像、病理)的重要补充。



